概要
いずれも高血糖緊急症ですが、急性の経過で進行しケトアシドーシスが目立つDKA、亜急性の経過で進行し脱水・高血糖が目立つHHS、に分類されます。
疫学
DKAは1型糖尿病に多いとされていますが、なんらかの疾患などが被った、あるいはインスリンなど糖尿病治療薬の怠薬、などがあると2型糖尿病にも起こりうるとされています。2型糖尿病は全症例の1/3を占めるとの報告もあります。(Diabet Med. 2008; 25: 867-70.)
65歳未満など若年例で多いですが、65歳以上での発生することももちろんあります。全症例のうち、70歳以上は14%、51-70歳は23%、30-50歳は27%、30歳未満で36%、という報告もあります。(Diabetes Res Clin Pract. 2007; 76: 51-6.)
DKAを契機に新規に糖尿病と診断されるのは27-37%と報告されています。(Am Fam Physician. 2013; 87: 337-46.)
HHSは2型糖尿病に多く、65歳以上など高齢者に多いのが特徴です。
平均で79.2±14.1歳という報告があります。(Diabetes Res Clin Pract. 2011; 94: 172-9.)
DKAの死亡率は低く1%以下と報告されていますが、HHSは高齢者に発生し合併症がある例も多いことから死亡率は高く10-20%と報告されています。(Diabetes Care. 2014; 37: 3124-31.)
病態
高血糖緊急症を引き起こす原因は
①インスリンの絶対量の欠乏
②インスリンの相対的な欠乏
③インスリン拮抗ホルモンの増加
の3つに大別されます。
※インスリン拮抗ホルモン
→グルカゴン、カテコラミン、コルチゾール、GH、など
→感染症、心筋梗塞、脳梗塞、など合併症により誘発され増加する
DKAは①±③によるものであることが多くインスリン欠乏の程度が重度である一方、HHSは②±③によるものであることが多くインスリン欠乏も軽度である程度のインスリンは担保されています。
DKAでは圧倒的にインスリンが欠乏しているため脂肪分解やケトン体産生が1日など急激な経過で起こり、ケトアシドーシスに至ります。
HHSでは脂肪分解やケトン体産生を引き起こすほどのインスリン欠乏ではないためケトアシドーシスはきたさないけれど、グルコース利用を十分に行うまでには不十分であるため数日以上などある程度の期間をかけて高血糖をきたします。(Diabetes Care. 2009; 32: 1335-43.)
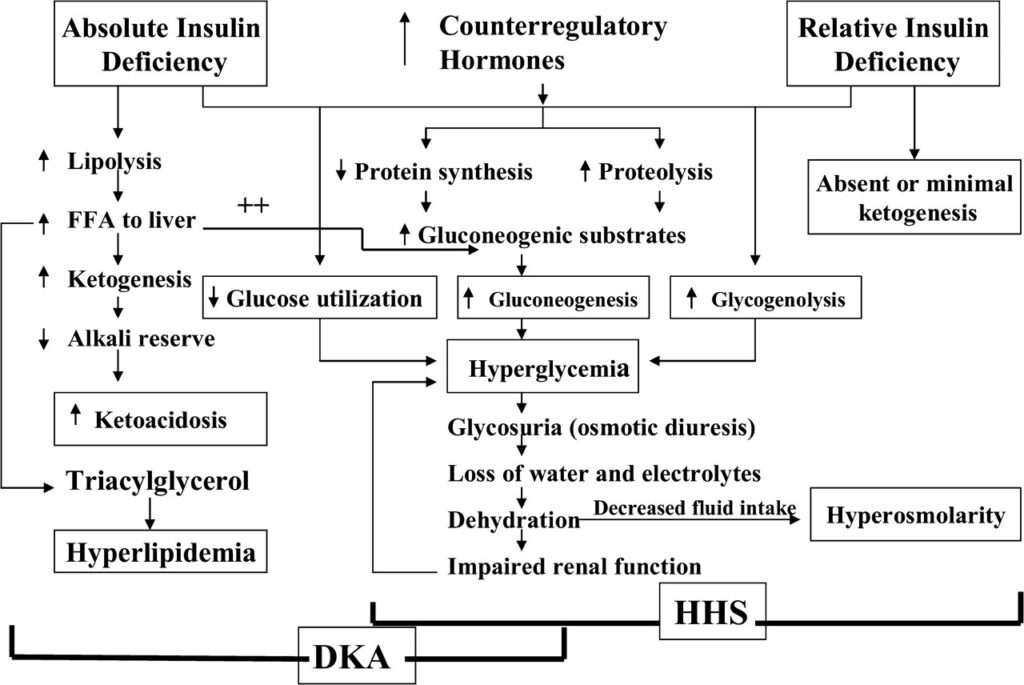
インスリンの欠乏あるいはインスリン拮抗ホルモン増加によって起こるのは、
①高血糖
②ケトアシドーシス
の2つです。
①高血糖
(1) 糖新生の増加
(2) グリコーゲン分解の増加
(3) グルコース利用障害
によっておこるとされています。(Diabetes Care. 2009; 32: 1335-43.)
糖新生については、インスリン欠乏やインスリン拮抗ホルモン増加により、
・脂肪分解や蛋白分解が起こり糖新生が促進される
・糖新生代謝経路の複数の酵素が活性化される(特にPEPCK:ホスホエノールピルビン酸カルボキシラーゼ)
ために促進されます。(BMJ. 2019; 365: I1114.)
そしてこの高血糖のために浸透圧利尿が起こり、脱水が引き起こされる、という経過になります。
②ケトアシドーシス
重度のインスリン欠乏とインスリン拮抗ホルモンの増加により、ホルモン感受性リパーゼが活性化し、脂肪が分解され遊離脂肪酸が増加します。(BMJ. 2019; 365: I1114.)
遊離脂肪酸はアセト酢酸とβ-ヒドロキシ酪酸に分解・酸化され、この結果としてケトーシスとアシドーシスが起こります。上述しましたが、ケトアシドーシスはインスリンの絶対的な枯渇がないと発生しにくいため、それが起こっているDKAでは見られますが、インスリン欠乏の程度が軽いHHSではケトアシドーシスはみられないかあっても軽度です。
原因
DKA/HHSの原因としては、~”I”が有名です。Iの頭文字をまとめたmnemonicsで、文献によって7Iだったり6Iだったり5Iだったりとまちまちです。
①Infection:感染症
→急性膵炎、肺炎、尿路感染症、など
②Infarction:梗塞
→心筋梗塞、脳梗塞など
③Infraction:怠薬
④Infant:妊娠
⑤Iatrogenic:医原性
→ステロイド、SGLT-2阻害薬、非定型抗精神病薬など
⑥Intoxication
→アルコール、コカインなど
⑦Idiopathic
→新規発症の1型糖尿病など
(Curr Emerg Hosp Med Rep. 2013; 1: 1-9.)
このうち原因として多いのは、感染症、怠薬、とされています。(Diabet Med. 2016; 33: 269-70.)
DKAでは原因の45%が感染症、20%がインスリンの怠薬、としている報告もあります。
HHSで感染症が誘引になるケースは多く、肺炎や尿路感染症が一般的です。(BMJ. 2019; 365: I1114.)
感染があっても発熱を呈さないことが多く、DKA/HHSではほとんどの症例で感染症のワークアップは必要になります。
薬剤性としては、ステロイド、SGLT-2阻害薬、非定型抗精神病薬(クロザピン、オランザピン、リスペリドン、など)、インターフェロン、交感神経刺激薬(ドブタミン、テルブタミン、など)、サイアザイド系利尿薬、ペンタミジン、免疫チェックポイント阻害薬、などが被疑薬になります。(Am Fam Physician. 2013; 87: 337-46.)
SGLT-2阻害薬は正常血糖ケトアシドーシスの原因として有名です。そのほか、妊娠、食事摂取不良、などがあると正常血糖ケトアシドーシスをきたしうるとされています。
また免疫チェックポイント阻害薬はirAEとして1型糖尿病を起こす可能性があり(症例の約1%)、うち約半分でDKAをきたすという報告もあります。(PMID 25905280)
症状
DKAもHHSも高血糖による症状が先行し、DKAあるいはHHSを発症し、特徴的な症状をきたす、という流れになります。
高血糖による症状として代表的なのは、多飲、多尿、疲労感、体重減少、などです。
正常血糖ケトアシドーシスでは高血糖による症状をきたさない場合もあります。
こういった症状をきたしながら、DKAあるいはHHSを発症します。
DKAではKussmaul呼吸や腹痛が見られるようになります。これはいずれもケトアシドーシスの結果です。つまり、ケトアシドーシスが存在するDKAでは頻繁に見られますが、ケトアシドーシスはないHHSでは見られにくい症状になります。
Kussmaul呼吸は深い呼吸を繰り返すものであり、アシドーシスの代償のため換気量をあげてCO2を排出する目的で行われます。
腹痛が起こる原因についてはまだはっきりしていませんが、発生率はケトアシドーシスの程度と相関すると言われており、ケトアシドーシスによる症状であることが示唆されています。(J Crit Care. 2002; 17: 63-7.)
HHSでは意識障害をきたすことがあります。主に血漿浸透圧 > 320~330 mOsmで意識障害をきたしうるとする報告もあります。血漿浸透圧上昇が目立つHHSのほうがより高頻度で意識障害をきたすことになります。(Med Clin North Am. 1995; 79: 39-52.)
ただしアシドーシスも意識障害を引き起こすため、重症のDKAでは意識障害を呈することに注意が必要です。(Diabetes. 2006; 7: 11-5.)
簡単にまとめると以下のようになります。(もちろん上に示した通り例外は起こりうるので注意が必要です。)
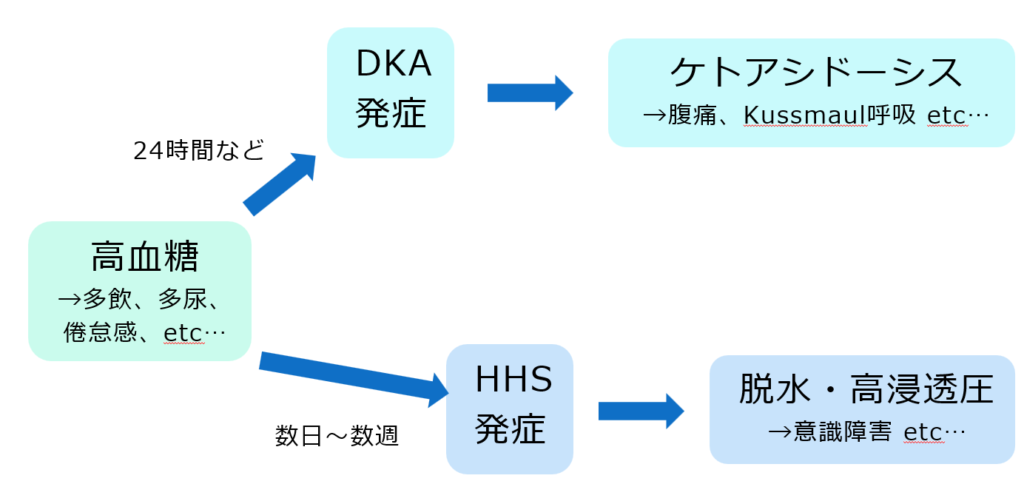
分類・診断基準
DKAとHHSを区別することは難しい(診断基準でもオーバーラップする部分はある)上に、両者合併することもあるので、明確な線引をするのは難しいです。一般的な診断基準としては以下の通り。
| 軽症DKA | 中等症DKA | 重症DKA | HHS | |
| 血糖値 | > 250 mg/dL | > 600 mg/dL | ||
| pH | 7.25 – 7.30 | 7.00 – 7.24 | < 7.00 | > 7.30 |
| HCO3– | 15 -18 | 10 – < 15 | < 10 | > 18 |
| 尿中ケトン | 陽性 | わずか | ||
| 血中ケトン | 陽性 | わずか | ||
| 血漿浸透圧 | 様々 | > 350 | ||
| アニオンギャップ | > 10 | > 12 | > 12 | 様々 |
| 意識レベル | 清明 | 清明 – 傾眠 | 混迷 – 昏睡 | 混迷 – 昏睡 |
DKAでは著明な高血糖をきたさない(正確には多くの症例で高血糖に至る前にケトアシドーシスが進行して発見される)一方で、HHSでは著明な高血糖にいたるまで進行し高血糖による症状で発見されます。
DKAは明らかなケトアシドーシスをきたしますが、HHSではそれほど目立ちません。
検査
・一般採血(血算、生化学、凝固など) → P, Mgも含めて採血
・血液ガス → 頻回なフォローが必要(後述)
・血漿浸透圧
・心筋逸脱酵素(トロポニンI)、心電図 → 虚血性心疾患が背景にないかチェック
・膵酵素(リパーゼ > アミラーゼ) → 膵炎がないかチェック
・HbA1c → 初療では必要ないが入院後のマネジメントに必須
・血中ケトン体 → 尿ケトンが陰性になる場合もあるので(後述)
・血液培養 → 感染が疑わしい場合(ほとんどは採取することになる、、)
・尿検査・尿培養 → 尿ケトン、尿路感染症のチェック
・造影CT → 膵炎が疑わしい場合
ナトリウムについて
DKA/HHSでは様々な要素によって血中ナトリウム濃度が変化します。
①高血糖→血漿浸透圧上昇→細胞内液から細胞外液への自由水の移動→血液希釈→血中ナトリウム低下
②高血糖→浸透圧利尿→自由水喪失→血液濃縮→血中ナトリウム上昇
③高血糖→浸透圧利尿→ナトリウム排泄→血中ナトリウム低下
尿からの損失がないと仮定した場合、理論的には、グルコースが100mg/dL上昇するごとに血中ナトリウムは1.6mEq/L低下するとされていますが (N Engl J Med. 1973; 289. 843-4.)、実際の症例ではグルコース100mg/dL上昇することにより血中ナトリウムは1.6-2.4mEq/L低下すると報告によってまちまちです (Nephrol Dial Transplant. 2014; 39: i1-39.)。グルコース100mg/dL上昇するごとに血中ナトリウムは大体2mEq/Lくらい低下する、というくらいのアバウトな認識でよいかと思われます。
カリウムについて
DKA/HHSの症例では、浸透圧利尿の影響で絶対的なカリウム欠乏を伴っています。しかしアシドーシスによる細胞外シフトの影響、インスリン不足、自由水喪失に伴う濃縮、といった複合的な要因によって、血中カリウム値は正常あるいは高値を示す場合もあります。(N Engl J Med. 1982; 307: 1603-10.)
大事なのは、DKA/HHSにおいては、血液検査での電解質は本来の状態を反映していない、という認識が重要です。カリウムだけでなくすべての電解質に対しても言えることですが、この中で特に臨床的に大事になるのはカリウムです。
ケトン体について
ケトン体には主に①アセト酢酸、②アセトン、③βヒドロキシ酪酸、の3種類がありますが、そのうちβヒドロキシ酪酸は尿検査で検出できません。アセトンもごく少量しか検出できず、主に検出できるのはアセト酢酸のみになります。DKAで発生するケトン体にはある程度アセト酢酸が含まれるとされており尿定性検査でも検出はできますが、それでも偽陰性になる可能性はあり、尿ケトン陰性だけをもってDKAを否定できません。(Am Fam Physician. 2013; 87: 337-46.)
きちんと評価をするためには血中ケトン体測定が必要になりますが、施設によっては緊急で行うことができないのが難点です、、、
ちなみに同様にケトン体が貯留する疾患であるアルコール性ケトアシドーシス(AKA)では貯留するケトン体分画のうちアセト酢酸の割合が低く、尿定性でケトン体陰性でも全く否定できないです。
急性期治療
多くの教科書や文献に記載があると思いますが、DKA/HHSの治療は、
①輸液、②カリウム補充、③インスリン投与、④原因の治療
がメインになります。その投与速度は文献によってまちまちですが、まずは多く引用されているAmerican Diabetes Association(ADA)のガイドラインの推奨を掲載します。(Diabetes Care. 2009; 32: 1335-43.)
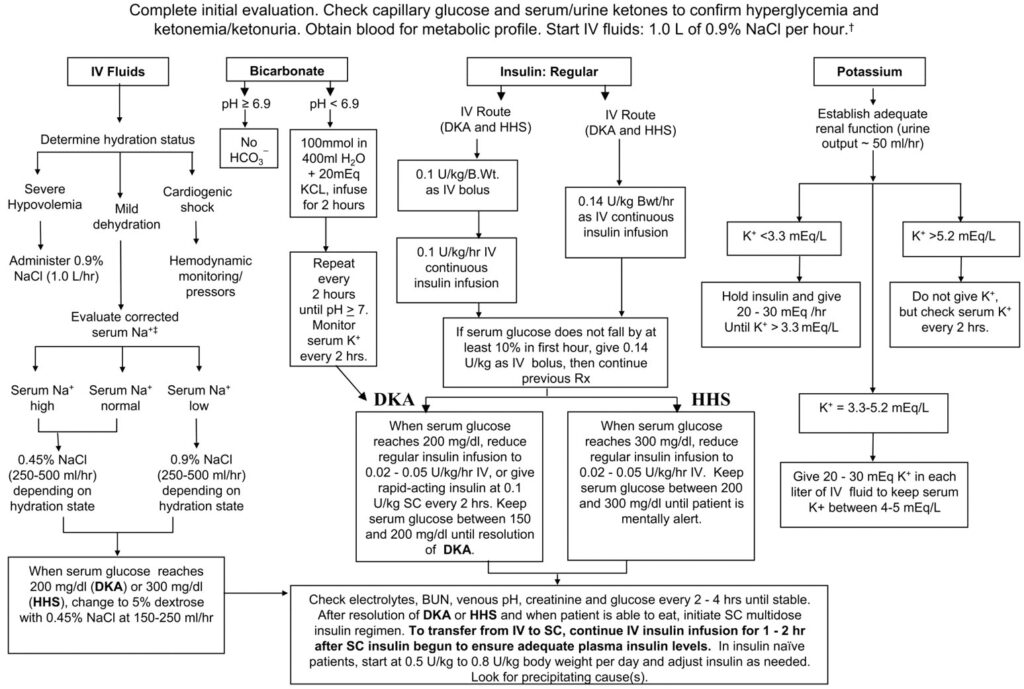
輸液
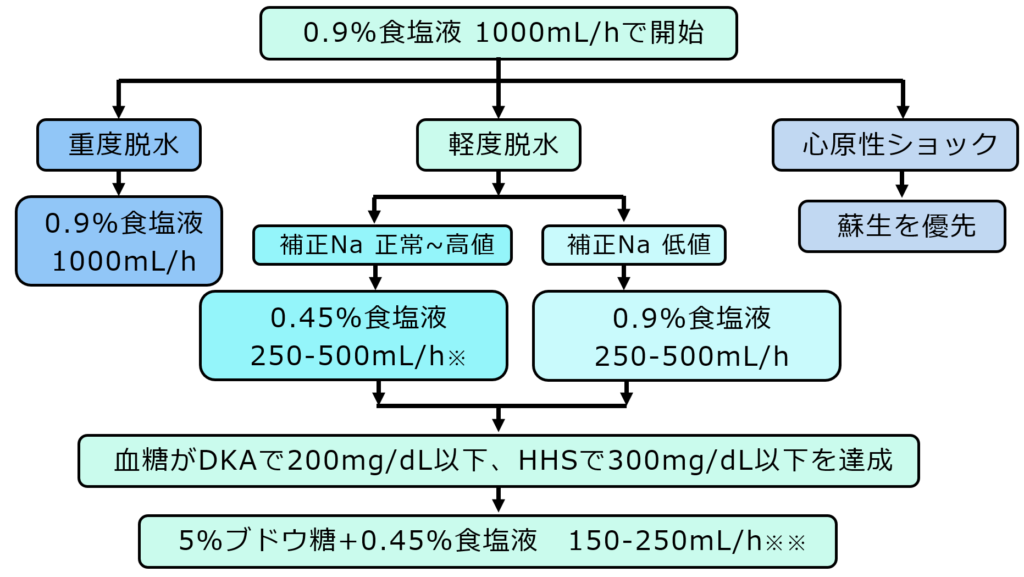
※1号液でも可
※※病態に応じて1号液ないしは3号液でも可
輸液は
①循環血漿量の回復
②ケトン体の排泄促進
③電解質異常の補正
を目的として行われます。
DKAとHHSでは体液量が枯渇した状態であり、DKAでは約6L、HHSでは約9Lの水分不足があると考えられています。(Endocrinol Metab Clin North Am. 2006; 35: 725-51.)
まずは血管内ボリュームの確保のために細胞外液を投与します。
急速補液だけでもインスリン拮抗ホルモンやインスリン抵抗性を減少させる効果があることは知られており、急速補液により血中グルコースは25-50mg/dL/hほど減少が見込めるという報告もあります。(Diabet Med. 2015; 32: 715-24.)
細胞外液として生理食塩水が用いられることが多いですが、最近ではリンゲル液も注目されており、どちらが優れるかについてはまだ結論が出ていません。(JAMA Netw Open. 2020; 3: e2024596.)
まずは細胞外液を1000mL/hの速度で開始します。
その後、身体所見、尿量、エコーなどから総合的に判断し、脱水が解除されてきたら250-500mL/h程度まで減量します。
このとき血中ナトリウムが低ければそのまま生理食塩水を、ナトリウムが正常ないしは高い場合は1/2生食を使用することがADAのガイドラインでは推奨されています。しかしこれを支持するエビデンスも否定するエビデンスもありません。さらにイギリスのガイドラインでは1/2生食にする必要はなくそのまま生食の投与を続けることが推奨されています。(Diabet Med. 2022; 39: e14788.)
また、日本の教科書では1/2生食の代わりに1号液を代用してもよいとされています。糖が少し含まれているますがそこまで気にする程度ではないので自分はこれを使用することが多いです。
DKAで血糖200mg/dL以下、HHSで血糖300mg/dL以下くらいまで低下したら、輸液に5%ブドウ糖を加えます。
これは高血糖とケトアシドーシスでは高血糖のほうが早く補正できるからです。つまり血糖値がある程度落ち着いてきていてもケトアシドーシスが改善していないことが多いです。(Diabetes Care. 2009; 32: 1335-43.)
ケトアシドーシス改善のためにはまだまだインスリンが必要であり、インスリンにより低血糖になるのを予防するために5%ブドウ糖を加えます。
アメリカのガイドライン(ADA)では5%ブドウ糖液が、イギリスのガイドライン(JBDS)では10%ブドウ糖液が推奨されていますが、両者比較した研究では10%ブドウ糖液のほうが高血糖になるリスクが高いとのことで、5%ブドウ糖液に軍配が上がる結果が報告されています。(Diabet Med. 1989; 6: 31-6.)
また、日本の教科書では「1/2生食+5%ブドウ糖」にこだわる必要はなくナトリウムの値に応じて1号液ないしは3号液でもよいとされています。投与速度も250-500mL/hにこだわる必要はなく、症例に応じて尿量や症状をみながら適宜変更してよいです。
カリウム
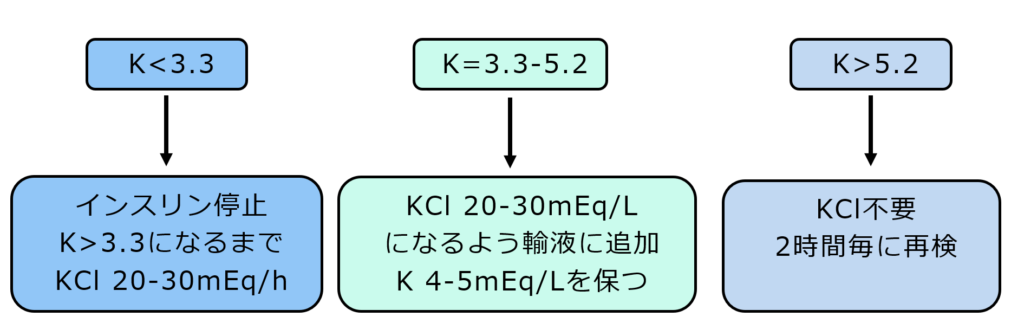
前述の通り、DKA/HHSでは体内のカリウムは絶対的に不足しています。それが様々な修飾因子により、血中カリウム濃度は高値になったり正常値になったり、あるいは低値になっていたり、とまちまちになっているという形です。
K<3.3 mEq/Lの場合は、
①KCl 20-30mEq/hの速度で補正を開始する
②さらなるK低下を防ぐためインスリンを停止する
ことが推奨されています。
K=3.3-5.2 mEq/Lの場合は、
①メインの輸液にKClを混注してKCl 20-30mEq/Lになるように調整する
②別途KCl入りの輸液を用意してメインとの合計で投与量がKCl 20-30mEq/Lになるように調整する
の2つの方法でKClの持続投与を行います。
K>5.2 mEq/Lの場合はKClの投与は不要です。
インスリン
インスリンによりカリウムや水分の細胞外→細胞内シフトが起こるため、初期輸液や低カリウム血症の補正が完了してから投与を開始します。(BMJ. 2019; 365: I1114.)
目安としては1時間の初期治療が終わって、かつ低カリウム血症が是正されていたら投与開始する、くらいではないでしょうか。
初期投与について、投与量、ボーラスの有無、はいずれも定まったものはありません。
・成人DKAで 0.07 単位/Kg のボーラス投与後に 0.07 単位/Kg/h の持続投与する群 vs ボーラスなしで0.14 単位/Kg/hで持続投与する群では治療効果・副作用ともに有意差なし。ただしボーラスなしで0.07 単位/Kg/hの持続投与のみでは治療効果不十分。(Diabete Care. 2008; 31: 2081-5.)
・小児DKAで 0.1 単位/Kg/h vs 0.05 単位/Kg/h の持続投与で両者に治療効果・副作用ともに有意差なし。(JAMA Pediatr. 2014; 168: 999-1005.)
などの報告があります。
ADAのガイドラインでは、
①0.1 単位/Kg/のボーラス→0.1 単位/Kg/hの持続投与
②0.14 単位/Kg/hの持続投与
の2つの初期投与のうちいずれかで開始し、
・血糖 50-70 mg/dL/h の速度
での血糖降下を目指し、これに合わせてインスリン投与量を増減し、
・DKAで血糖 200mg/dL、HHSで血糖 300mg/dLを達成したら、インスリンは0.02-0.05 単位/Kg/hに減量する
・寛解状態までは、DKAで血糖 150-200mg/dL、HHSで血糖 200-300mg/dLにキープするように調整する
ということが推奨されています。
これは人種差なのかはわかりませんが日本人だと0.1単位/Kg/hだと血糖値が下がりすぎてしまうこともしばしばあり、半量からスタートしてもよいかもしれません。
また上述の通りHHSではインスリン欠乏がそこまで重篤でないことも多い(主な病態は高血糖による脱水)ので、インスリンが不要、あるいはもし必要であったとしても半量からスタート、くらいでよいかもしれません。
また皮下注でも代用できるという報告もあります。
インスリンリスプロやアスパルトを、
・0.2単位/Kg 皮下注した後、0.1単位/Kgを1時間ごとに皮下注
・0.3単位/Kg皮下注した後、0.2単位/Kgを2時間ごとに皮下注
することでも静注に比べて必要インスリン量や副作用は変わらなかったという報告もあります。(Diabete Care. 2004; 27: 1873-8., Am J Med. 2004; 117: 291-6.)
アシドーシス
明確なエビデンスはありませんが、pH < 6.9の場合には重炭酸ナトリウム(メイロン®)の投与を考慮します。
重炭酸投与により低カリウム助長(→アシドーシス改善に伴う細胞内シフトのため)、組織への酸素供給量低下(→Hb-O2解離曲線の左方移動のため)、脳浮腫、などの懸念もあり、リスクを踏まえてもアシドーシスが高度で許容できない場合にのみ投与します。(N Engl J Med. 2001; 344: 264-9.)
使用する場合は
メイロン® 8.4% 100mL + 5%ブドウ糖液 400mL + KCl 20mEq
を混注した製剤を、pH>7.0を達成するまで200mL/hの速度で投与します。
急性期治療をやめる目安
DKAでは「ケトアシドーシスの改善」、HHSででは「高浸透圧状態の改善」をもって急性期治療をストップします。
DKAでは以下の①~③を達成することが基準となっています。(Diabetes Care. 2009; 32: 1335-43.)
①血糖 < 200 mg/dL
②食事摂取可能
③つぎの3項目のうち2つ以上を達成
・HCO3- ≧ 15 mEq/L
・静脈pH > 7.3
・アニオンギャップ ≦ 12 mEq/L
HHSでは明確な基準はありませんが、
①意識状態の改善、全身状態の改善
②食事摂取可能
③計算値での血漿浸透圧正常化
などを目処に急性期治療の中止を検討します。
食事摂取が難しい例ではインスリン持続投与と輸液を継続することが望ましいです。
急性期治療をやめたら
輸液を中止し、食事を開始し、インスリン皮下注射を開始します。
①インスリンの種類
超速効型+持効型の組み合わせ、いわゆる「Basal-Bolus therapy」を行います。
持効型を1日1回、それに加えて超速効型を食前に投与します。
DKAにおいて超速効型+持効型の組み合わせは、NPHあるいはレギュラーインスリンを1日2,3回投与するのに比べて治療効果は変わらなかったが低血糖イベント発生率が少なかったという報告があります。(Diabete Care. 2009; 32: 1164-9.)
②インスリンの投与量
DKA/HHS発症前にすでにインスリンを使用していた症例については、そのままの投与量から開始してもよいです。
以前インスリンを使用していなかった症例については、1日インスリン量(Total daily dose : TDD)を
A) 0.5-0.8 単位/Kg
B) 中止前のインスリン投与量( X 単位/h) × 24h
から設定し、それを超速効型と持効型に分配します。
TDDのうち半分を持効型に、もう半分を超速効型に分配し、超速効型は毎食前に投与するので更に3で割って、各々の投与量を計算します。
(例) 体重60Kgの人
TDD = 60×0.5 = 30単位
→持効型15単位、超速効型15単位
→超速効型は毎食前に投与するので、1回投与量は 15/3 = 5
→5-5-5-15での投与
③インスリンのタイミング
大事なのは、超速効型の投与を開始してからもインスリン持続注射を数時間継続する必要があることです。これはインスリン持続注射の半減期が短い(約10分)ために、最初は皮下注射と持続注射で同時投与しないとインスリン不足により高血糖あるいはケトアシドーシスが再発する可能性があるためです。(BMJ. 2019; 365: I1114.)