概要
集中治療医としては治療に当たる頻度も高く、集中治療に携わる人は抑えておくべき項目です。
自分としても細部が抜けていることを痛感しており、これを期にまとめてみました。
アルゴリズム
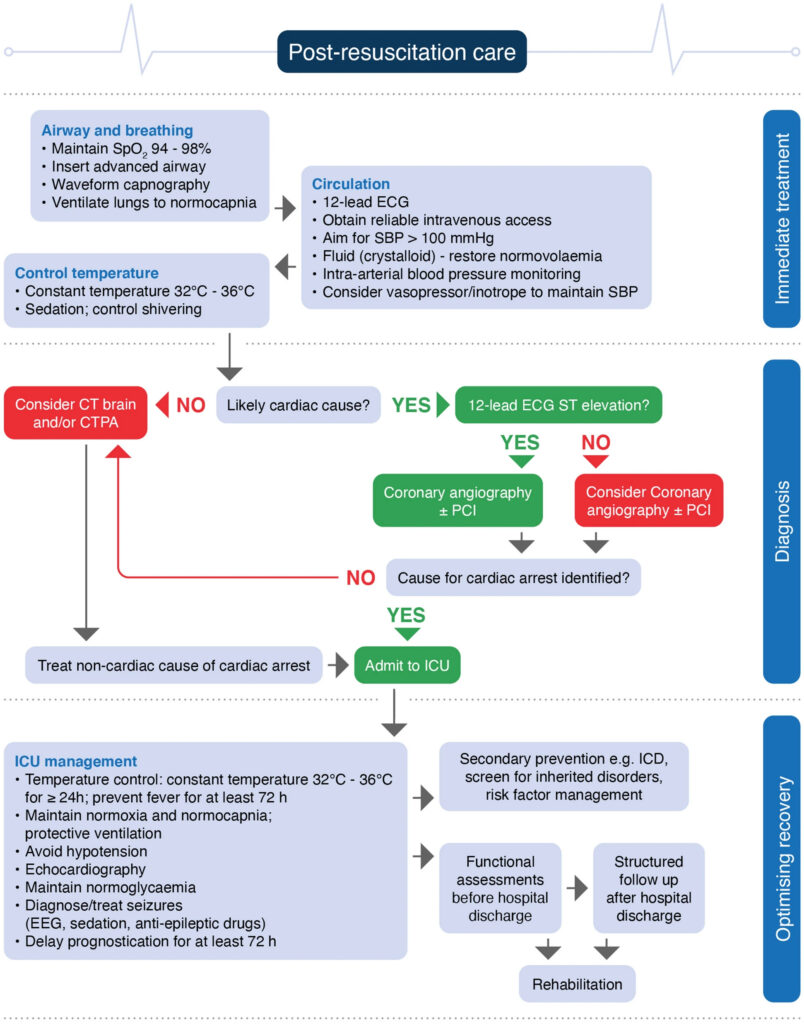
(Intensive Care Med. 2021; 47: 369-421.)
ERC/ESCIMガイドラインから引用しています。
基本的な流れは、
①初療時に安定化
②CAG/PCIの必要性を検討
③ICUでの全身管理
④体温管理療法
⑤神経学的予後評価
となります。
初療時の安定化
Airway
基本的には気管挿管を行います。ガイドライン上は心停止が短時間で、脳機能正常、正常な呼吸をしている場合は気管挿管不要とされております。
Breathing
PaO2 75-100mmHg、SaO2 94-98%、PaCO2 35-45mmHg、を目標にします。
人工呼吸器で管理している場合は、一回換気量(TV) 6-8mL/Kgに設定します。
Circulation
MAP≧65mmHgを維持し、尿量≧0.5mL/Kg/hで、乳酸が低下経口になるように循環管理を行います。輸液やカテコラミンでコントロールを行います。コントロールがつかない場合はメカニカルサポート(IABP、VA-ECMO、Impella®、など)を考慮します。
再灌流療法
ST上昇がある場合は緊急CAG/PCIの適応です。
ST上昇がない場合はcontroversialで、症例に応じてACSの可能性が高ければ緊急CAGを行います。
これにはいくつかのtrialでST上昇のない心停止における緊急CAGの有用性が否定されているためです。
有名なものとしては以下のものが挙げられます。
①COACT trial:初期波形がVF/pulseless VTで蘇生後にST上昇がない院外心停止症例において、緊急CAGを行っても90日生存率は改善しない (N Engl J Med. 2019; 380: 1397-407.)
②TOMAHWAK trial:初期波形によらず蘇生後にST上昇がない院外心停止症例において、緊急CAGを行っても30日死亡率は改善しない (N Engl J Med. 2021; 385: 2544-53.)
③EMERGE trial:初期波形によらず蘇生後にST上昇がない院外心停止症例において、緊急CAGを行っても180日後に神経学的に良好で生存する割合は変わらない (JAMA Cardiol. 2022; 7: 700-7.)
全身管理
一般的なICU管理
循環:MAP≧65mmHg、尿量>0.5mL/Kg/h、乳酸正常範囲内
呼吸:PaO2 75-100mmHg、SaO2 94-98%、PaCO2 35-45mmHg、TV 6-8mL/Kg
と初期治療と同様の目標値で治療していきます。
血糖値は一般的なICU管理範囲内でOKです。140-180mg/dLなど。
VAP予防、ストレス潰瘍予防、VTE予防、などルーチンケアも忘れずに行います。
Seizure/Myoclonusへの対策
明らかにけいれん(convulsion)がある場合は、それがseizureなのか鑑別するためにも脳波検査を行います。seizureであれば鎮静薬(ベンゾジアゼピン系やプロポフォール)に加えてレベチラセタムやバルプロ酸による治療を行います。
明らかにseizureがない場合は、今のところルーチンに予防薬を投与する必要はないとされています。
またけいれん(convulsion)がない場合ルーチンに持続脳波をとるか(→つまり、NCSEをみつけにいくか)については、controversialな部分です。PCASにおけるてんかん波に対して抗てんかん薬で治療しても予後は変わらなかったという報告 (N Engl J Med. 2022; 386: 724-34.)もあり、今後推奨が変わってくるかもしれない項目です。
一過性のミオクローヌス自体はあまり治療しても予後に影響を与えないとされていますが、
①Status Myoclonus (ミオクローヌス重積状態):30分以上全般化したミオクローヌスが続くもの
②Myoclonic epilepsy (ミオクローヌスてんかん):ミオクローヌスにてんかん波を伴うもの
であれば治療を検討します。そのためミオクローヌスをみたら脳波検査を行います。
治療対象のミオクローヌスと判断したら治療を行います。通常使用している鎮静薬(ベンゾジアゼピン系やプロポフォール)を増量する、クロナゼパム、レベチラセタム、バルプロ酸を追加する、などの方法を検討します。
けいれんやミオクローヌスが重積している場合は予後不良ですが、かといってこれを治療したとして転帰は改善できない、という報告もあります。 (Neurocrit Care. 2012; 16: 114-22.)
現状はまだ定まっていない部分であり、今後の研究が待たれます。
体温管理療法
・適応
ROSC後に意識障害が改善しない症例においては、基本的に体温管理療法の適応になります。
・開始時期
治療開始が遅れると神経学的予後につながるという報告もあり (Resuscitation. 2012; 83: 829-34.)、なるべく早期に始めるべきであるとされています。
しかしROSC前に低体温療法を導入することの有用性はないとされており (Intensive Care Med. 2020; 46: 1361-70.)、「ROSC後なるべく早期に」、というのが一般的です。
・方法
一般的には血管内冷却装置(Cool Line®など)、水循環ジェルパッド(Arctic Sun®など)、が用いられることが多いように思います。
冷却輸液、氷嚢、ブランケット、ジェルパッド、血管内冷却装置、などの選択肢がありますが、この中では血管内冷却装置が一番早く目標体温まで到達し、また冷却期間中に目標体温から逸脱する時間も少なかったという報告があります。 (Crit Care. 2007; 11: R91.)
一方で血管内冷却装置やジェルパッドを使用しても神経学的予後は改善しないという報告もあります。(Crit Care Med. 2011; 39: 443-9., Resuscitation. 2010; 81: 9-14.)
・目標体温
目標体温については、まだ明確に決まったものはありません。今のところ出ているエビデンスは以下のようなものがあります。
①TTN trial:院外心停止で初期波形がshockable rhythmの症例で、体温目標を33℃にした場合と36℃にした場合で6ヶ月後の死亡率も神経学的予後も変わらない (N Engl J Med. 2013; 369: 2197-200.)
②TTN2 trial:院外心停止で、体温目標を33℃にした場合と37.8℃以下にした場合で6ヶ月後の死亡率も神経学的予後も変わらない (N Engl J Med. 2021; 384: 2283-94.)
③HYPERION:院外心停止でnonshockable rhythmの症例で、体温目標を33℃にした場合と37℃にした場合、90日後の死亡率は変わらないが、33℃の群で神経学的予後は有意に改善 (N Engl J Med. 2019; 381: 2327-37.)
・モニタリング
頭蓋内の温度に近づけるため、という理由で深部体温を指標にします。
中心静脈の温度がよく用いられますが、その他には食道温、膀胱温、直腸温、が用いられます。
・有害事象
①シバリング
シバリングは体温低下に対する生理的な反応ですが体温を上昇させる危険があるため発生しないようにする必要があります。鎮静薬を使用し、シバリングスケールであるBSAS=0にコントロールします。(Stroke. 2008; 39: 3242-7.)
②凝固障害
低体温だと凝固障害が発生し、出血イベントが発生する可能性があります。著しい凝固障害がある場合は体温管理療法の期間をなるべく短くする、許容できない出血イベント(脳出血など)が起こった場合は中止する、といった配慮が必要です。
③不整脈
徐脈、QT延長、などの不整脈イベントが発生する可能性があり、心電図モニターで注意深く観察しておく必要があります。
・復温
代謝速度や電解質濃度が急激に変化する可能性があるため、緩徐に復温することが必要とされており、ガイドライン上は0.25-0.5℃/hで復温することが推奨されています。
≧0.5℃/hで復温させた場合と<0.5℃/hで復温させた場合で予後が変わらなかったという報告もあり (Resuscitation. 2012; 83: 996-1000.)、今後推奨が変わるかもしれません。
・期間
ガイドライン上は体温管理療法は24時間以上、高体温の回避は72時間以上行うべきとされています。体温管理療法は24時間vs72時間で予後に差が出なかったという報告(Circ J. 2011; 75: 1063-70.)や、24時間vs48時間で予後の差が出なかったという報告(JAMA. 2017; 318: 341-50.)、があります。
復温後の高体温は神経学的転帰不良と関連するという報告がいくつかあり、避けるべきとされておりますが、いつまで避けるべきなのかということについてはまだ結論が出ておらず、これについてはさらなる検討が必要です。
神経学的予後評価
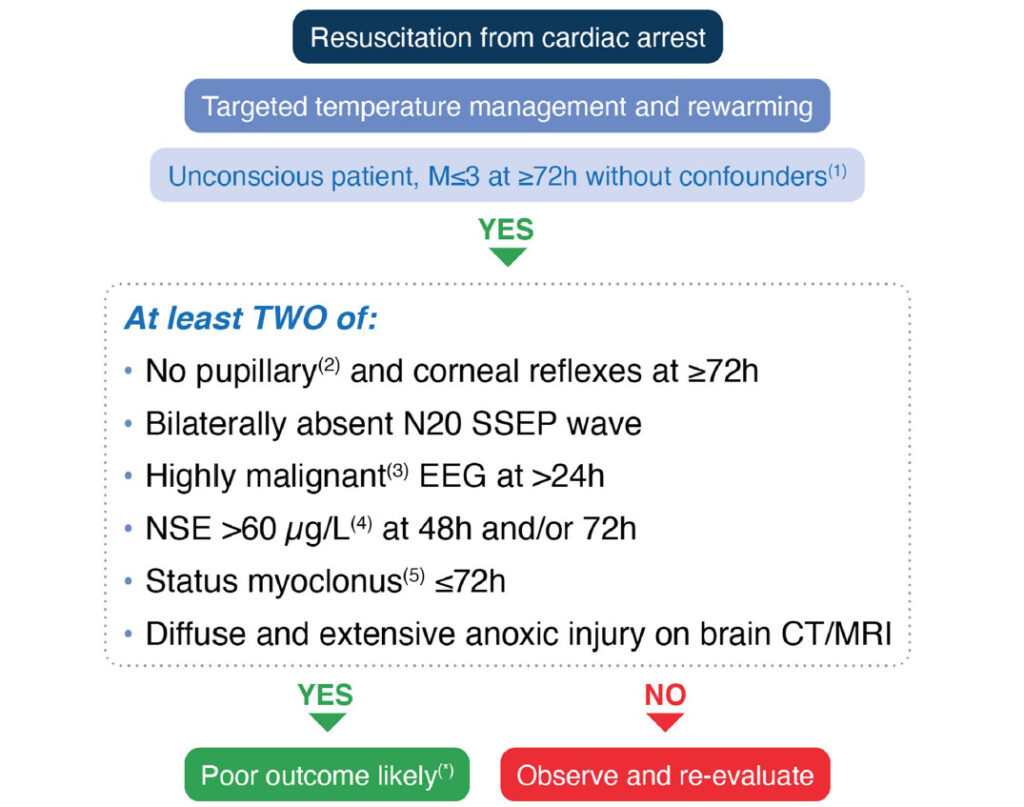
(Intensive Care Med. 2021; 47: 369-421.)
ROSCして72時間後、意識障害があり、GCSのM≦3で、修飾因子がない場合に行います。修飾因子とは、鎮静薬使用、筋弛緩薬使用、低体温、重度の低血圧、低血糖、敗血症、代謝異常、呼吸異常、などが挙げられます。
①ROSCから72時間以降の対光反射および角膜反射の消失
②両側N20でのSSEP(体性感覚誘発電位)消失
③ROSCから24時間以降の悪性な脳波所見(→suppression ± periodic discharges, or burst suppression)
④ROSCから48時間後ないしは72時間後に測定したNSE > 60 μg/L
⑤ROSCから72時間以内のミオクローヌス重積状態(→全身性ミオクローヌスが30分以上継続)
⑥CTやMRIでの広範囲かつ高度な軸索損傷の所見(→低酸素脳症の所見)
のうち、2項目以上が該当する場合には予後不良群、0-1項目の場合は経過観察群、となります。
※burst suppression (Neurocrit Care. 2020; 33: 565-74.)
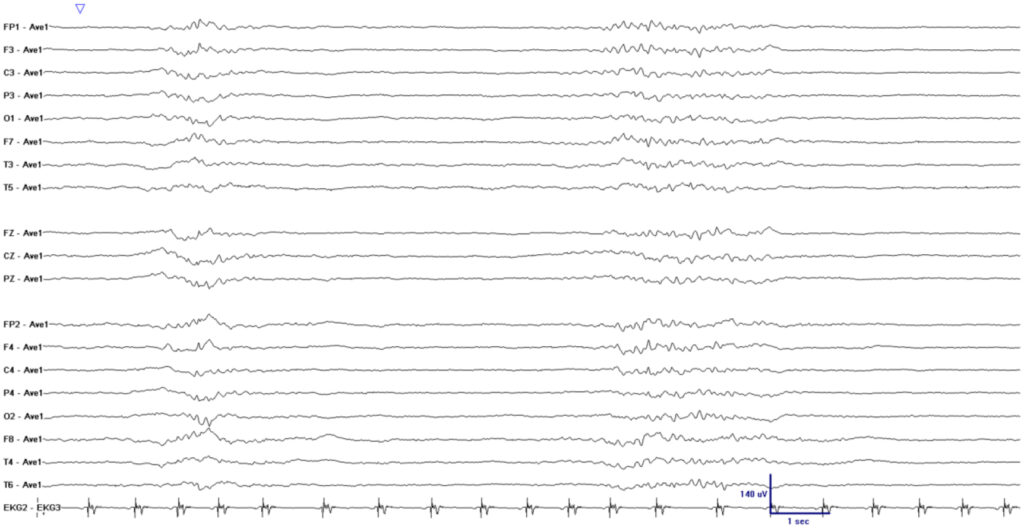
※suppression + periodic discharge
さいごに
PCASの管理について、ESC/ESICMガイドラインをベースにまとめてみました。
まだまだ定まっていないことも多く、今後のアップデートが待たれます。